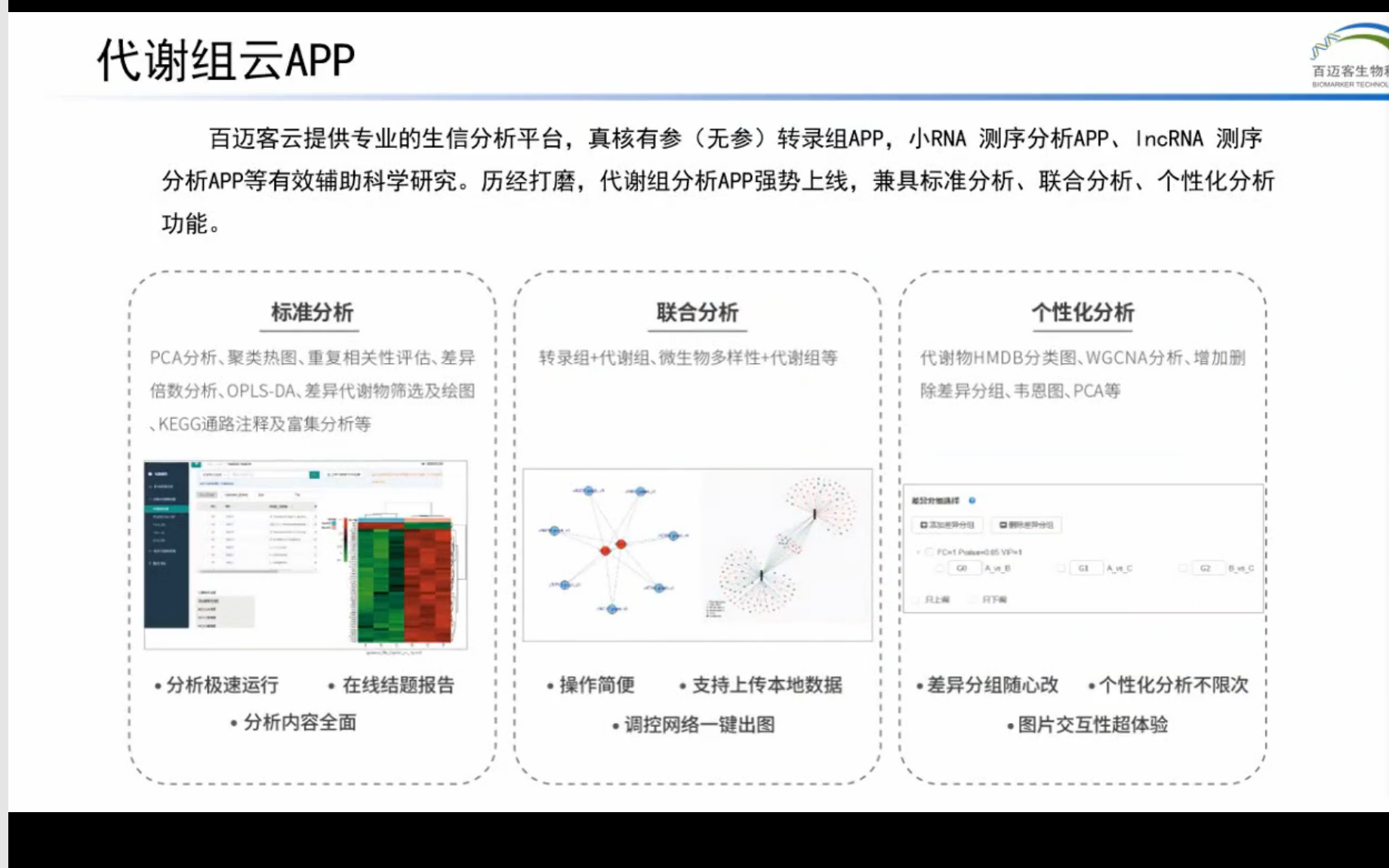
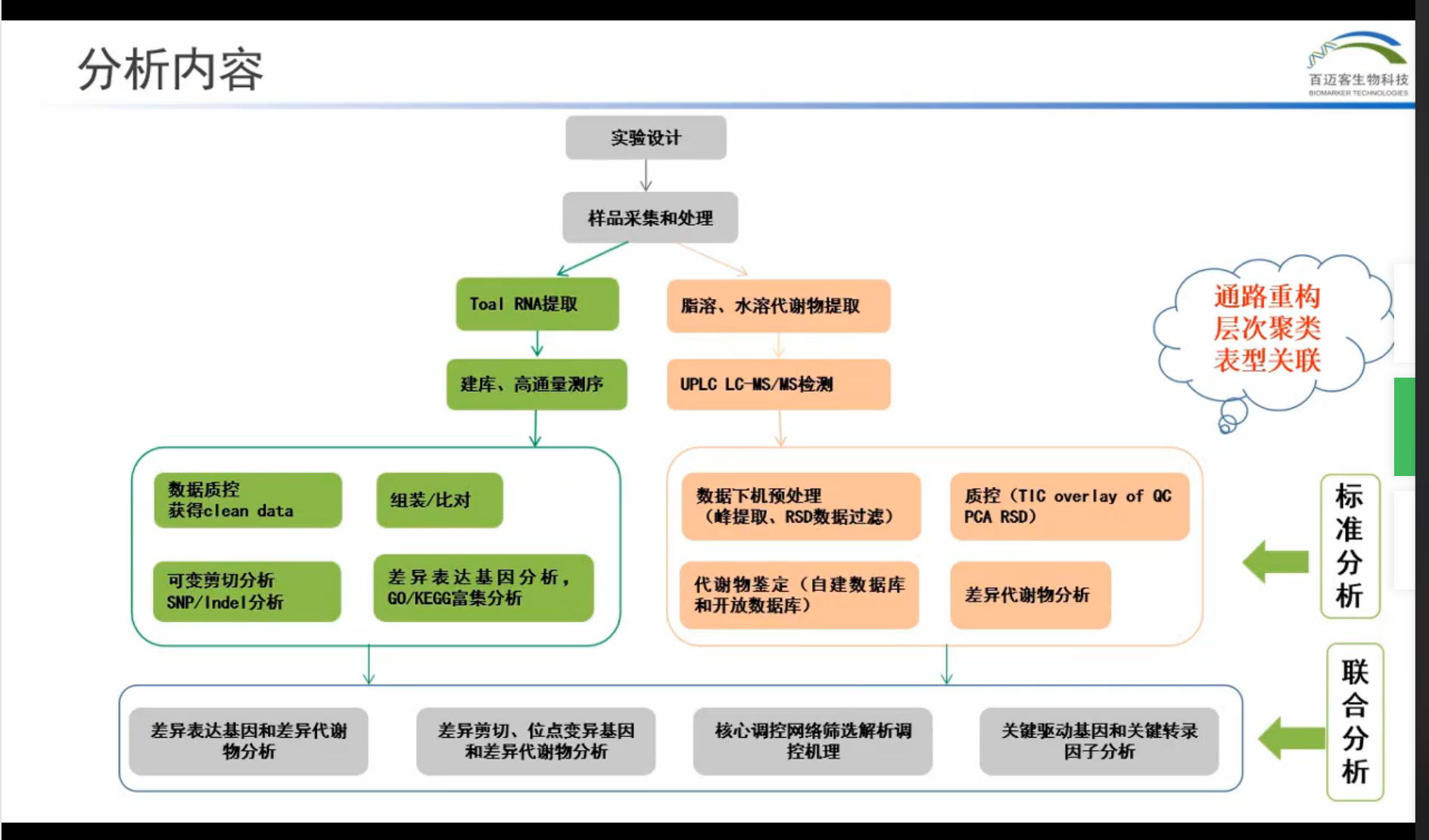
代谢组学技术原理和方案设计:
代谢物的结构种类繁多、理化性质差异巨大、含量极微且动态范围极宽(7~9数量级)、时空分布的差异明显、相互作用方式复杂。
色谱技术-物质分离:GC(流动相为惰性气体,主要是利用物质的沸点、极性及吸附性质的差异来实现混合物的分离);LC(流动相为液体,利用物质在两相中分配系数的差异进行分离,类似于萃取过程)。
质谱技术-物质鉴定:测量例子质鹤比(质量-电荷比),原理是样品在资源中发生电离,参茶不同荷质比的带电离子,经加速电场的作用,形成离子束,进入质量分析器。
样品引入(气体扩散、气相色谱、液相色谱)→离子源(电子轰击EI、激光MALDI、电喷雾EDI)→质量分析器(飞行时间TOF、四级杆滤质分析器QMF、离子阱、离子迥旋共振分析器ICR)→检测器(电子倍增管及其阵列、离子计数器、感应电荷检测器、法拉第收集器)→图谱。
色质联用:包括气质联用和液质联用,互为补充,分析不同性质的化合物,混合物的定性和定量分析。
平台比较:(1)核磁共振NMR:无创检测,样本需求量小,但动态范围有限,灵敏度较低;(2)液质联用LC-MS:灵敏度、分标率高,检测动态范围较宽;(3)气质联用GC-MS:数据库较全,但检测物质范围有限。
研究技术:(1)非靶向代谢组学(简单):同时检测数百乃至数千种代谢物,包括已知和未知代谢物,但敏敏度较之八项代谢组减低1-2个数量级,定性定量准确性也相对较差;优点,通量高、检测信号多、操作简单。(2)靶向代谢组学(复杂,需预实验):只能对少数一直代谢物进行定性和定量检测,但其具有灵敏度高、定量准确的特点;优点,定性准、绝对定量。
高通量靶标:多个标准品的预实验已有成熟体系,一次性检测样品中多个代谢物的靶点代谢组。
技术特点(相当于):非靶向代谢组——高通量测序;靶向代谢组——RT-PCR;高通量靶标代谢组——基因芯片。
方案设计:设置出对照组、实验组即可。(1)简单方案:对照组和处理组整体变化,大项目往往采用,每组可设几百个重复,数据更有说服力,能发更高分文章。(2)经典方案:可设置对照组,两个不同处理组,可以差异比较三次。(3)高阶方案:设置三组,每组设置不同程度处理,对比次数多,土豪方案。
生物学重复,不建议混样:(1)植物和微生物:6~8个;(2)模式动物:8~12个;(3)临床标本:30~100个。越多越好。
多组学联合分析:(1)基因组+转录组:静态,相对稳定;(2)蛋白质组+代谢组:动态,实时变化。蛋白代谢是生物体表型的基础和直接体现者,是基因组与表型组的桥梁;(3)代谢组+转录组;(4)代谢组+重测序(GWAS);(5)代谢组+微生物多样性。
代谢组流程:样本收集(微生物、细胞体液、植物,淬灭、液氮,生物学重复),代谢物提取(溶剂提取法、固相萃取),代谢物检测(LC-MS、GC-MS、毛细管电泳质谱CE-MS、电感耦合离子体质谱ICP-MS、超临界流体质谱SFC-MS、核磁共振、液相色谱串联核磁共振),数据分析(主成分分析、偏最小二乘法、正交信号过滤法、神经网络法、支持向量机,代谢物鉴定)
代谢物相对定量:积分校正图。
数据分析流程:质控结果数据→数据评估(PCA、样品聚类、相关性分析,对象为所有样品)→数据分组→差异分析(差异倍数、OPLSDA模型计算,若无生物学重复,则无法进行OPLSDA计算)→差异代谢物→功能分析(功能注释、富集分析)。QC样本:监控整个检测过程中的稳定性。